5月11日��,深圳理工大學(xué)(籌)藥學(xué)院/中國(guó)科學(xué)院深圳先進(jìn)技術(shù)研究院王崇元團(tuán)隊(duì)與徐州醫(yī)科大學(xué)張赭團(tuán)隊(duì)合作���,在期刊Nature Communications上發(fā)表了題為Structural insights into drug transport by an aquaglyceroporin的研究論文。(點(diǎn)擊文末“閱讀原文”閱讀論文)研究首次揭示了水通道蛋白介導(dǎo)藥物轉(zhuǎn)運(yùn)的分子機(jī)制�,為新型藥物的研發(fā)提供了新思路。
布氏錐蟲(Trypanosome)是引起人類昏睡病和動(dòng)物錐蟲病的病原微生物�。噴他脒(pentamidine)和美拉砷醇(melarsoprol)作為錐蟲病的治療藥物已有超過70年的歷史,并且目前仍在使用����。與大多數(shù)藥物不同��,噴他脒并非通過抑制錐蟲體內(nèi)特定蛋白靶點(diǎn)���,而是通過結(jié)合DNA來抑制復(fù)制和翻譯過程來達(dá)到殺蟲作用����。因此,只有藥物在錐蟲體內(nèi)積累到幾個(gè)毫摩爾的濃度才能起到殺蟲作用����。錐蟲水通道AQP2(TbAQP2)對(duì)噴他脒和美拉胂醇的吸收和富集起到關(guān)鍵作用,其基因突變是導(dǎo)致交叉耐藥的首要原因���。美拉砷醇和噴他脒的尺寸遠(yuǎn)大于水通道的常規(guī)底物���,其分子量是水分子的20倍、甘油的4倍�����。TbAQP2也是目前被報(bào)道的唯一具有藥物轉(zhuǎn)運(yùn)功能的水通道蛋白�,其背后的分子機(jī)制困擾著領(lǐng)域多年。
為了以更簡(jiǎn)便快速的方式研究TbAQP2的轉(zhuǎn)運(yùn)活性����,研究團(tuán)隊(duì)使用噴他脒的熒光類似物作為底物,開發(fā)了基于HEK293細(xì)胞的轉(zhuǎn)運(yùn)實(shí)驗(yàn)����,在哺乳動(dòng)物細(xì)胞中實(shí)現(xiàn)了TbAQP2的藥物轉(zhuǎn)運(yùn)功能重構(gòu)�。實(shí)驗(yàn)顯示TbAQP2在哺乳細(xì)胞中也表現(xiàn)出極高的效率�,可以在1分鐘內(nèi)把藥物轉(zhuǎn)運(yùn)至胞內(nèi),證實(shí)TbAQP2在哺乳細(xì)胞內(nèi)也表現(xiàn)出藥物轉(zhuǎn)運(yùn)功能����。在功能分析的同時(shí),研究團(tuán)隊(duì)利用Bac-Mam體系表達(dá)���,并通過脂納米盤技術(shù)純化得到了TbAQP2蛋白�。隨后�,利用單顆粒冷凍電鏡技術(shù)成功解析了TbAQP2無底物狀態(tài)的結(jié)構(gòu),分辨率為3.2埃��。TbAQP2主體結(jié)構(gòu)展現(xiàn)出經(jīng)典的四聚體水通道模式���,通過結(jié)構(gòu)分析�,相比于轉(zhuǎn)運(yùn)水�、甘油等小分子量底物的水通道蛋白(如人源AQP1、AQP4等)���,TbAQP2的跨膜通道明顯大一些����,使其轉(zhuǎn)運(yùn)藥物等大分子量的底物成為可能����。
為了進(jìn)一步揭示藥物轉(zhuǎn)運(yùn)的分子機(jī)制,研究團(tuán)隊(duì)又成功解析了TbAQP2與噴他脒��、美拉胂醇結(jié)合的復(fù)合物結(jié)構(gòu)�����,分辨率為2.4埃�。高質(zhì)量的電鏡密度使我們可以直接觀察到噴他脒和美拉胂醇結(jié)合的位點(diǎn)以及相互作用的氨基酸,并通過突變和轉(zhuǎn)運(yùn)分析驗(yàn)證了這些氨基酸的重要性�。雖然噴他脒和美拉胂醇的結(jié)構(gòu)式存在顯著差異,但它們都以伸展的構(gòu)象結(jié)合在TbAQP2跨膜通道中��。然而�,它們的高親和力結(jié)合位點(diǎn)并不重疊,噴他脒位點(diǎn)靠近胞內(nèi)區(qū)�����,而美拉胂醇位點(diǎn)靠近胞外區(qū)��。這兩種底物主要通過疏水相互作用與氫鍵與跨膜通道結(jié)合,TbAQP2通過對(duì)底物形狀的識(shí)別和特定基團(tuán)的結(jié)合來實(shí)現(xiàn)特異性轉(zhuǎn)運(yùn)��。這些結(jié)構(gòu)信息為基于TbAQP2跨膜通道設(shè)計(jì)新型昏睡病治療藥物奠定了基礎(chǔ)�。
此外,為了進(jìn)一步探究藥物分子的轉(zhuǎn)運(yùn)途徑����,研究團(tuán)隊(duì)對(duì)TbAQP2-噴他脒復(fù)合物進(jìn)行了分子動(dòng)力學(xué)模擬分析。在模擬的時(shí)間尺度中���,可以清晰地觀察到噴他脒分子沿TbAQP2通道轉(zhuǎn)運(yùn)進(jìn)入細(xì)胞�����,同時(shí)還發(fā)現(xiàn)噴他脒轉(zhuǎn)運(yùn)過程具有膜電位依賴性���,這與之前的錐蟲實(shí)驗(yàn)觀察結(jié)果一致。
總之����,本研究通過結(jié)構(gòu)生物學(xué)、細(xì)胞生物學(xué)及分子動(dòng)力學(xué)模擬等實(shí)驗(yàn)手段首次揭示了水通道蛋白介導(dǎo)藥物轉(zhuǎn)運(yùn)的分子機(jī)制為新型藥物的研發(fā)提供了新思路��。

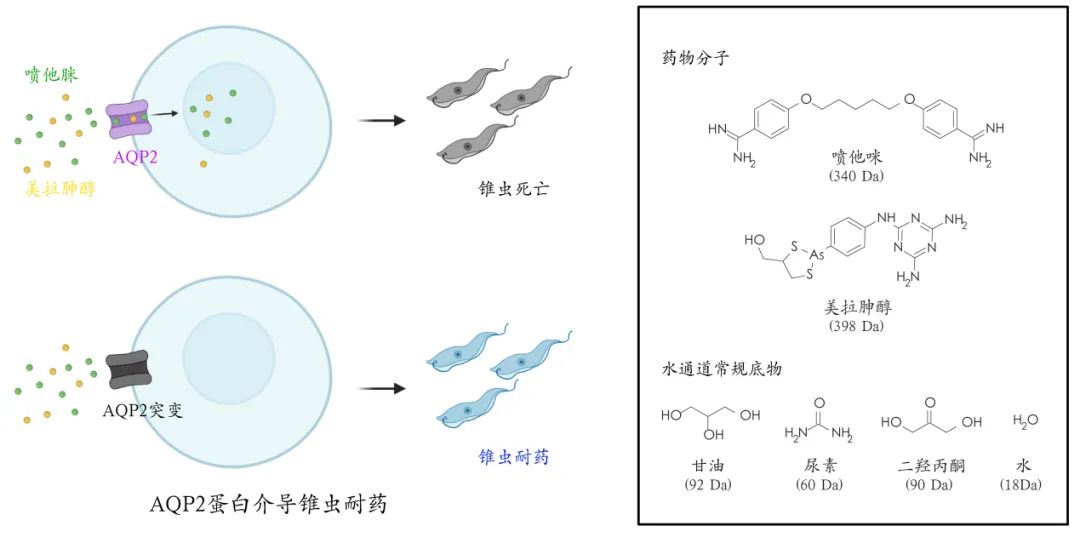
TbAQP2介導(dǎo)藥物轉(zhuǎn)運(yùn)����,是錐蟲耐藥的關(guān)鍵基因
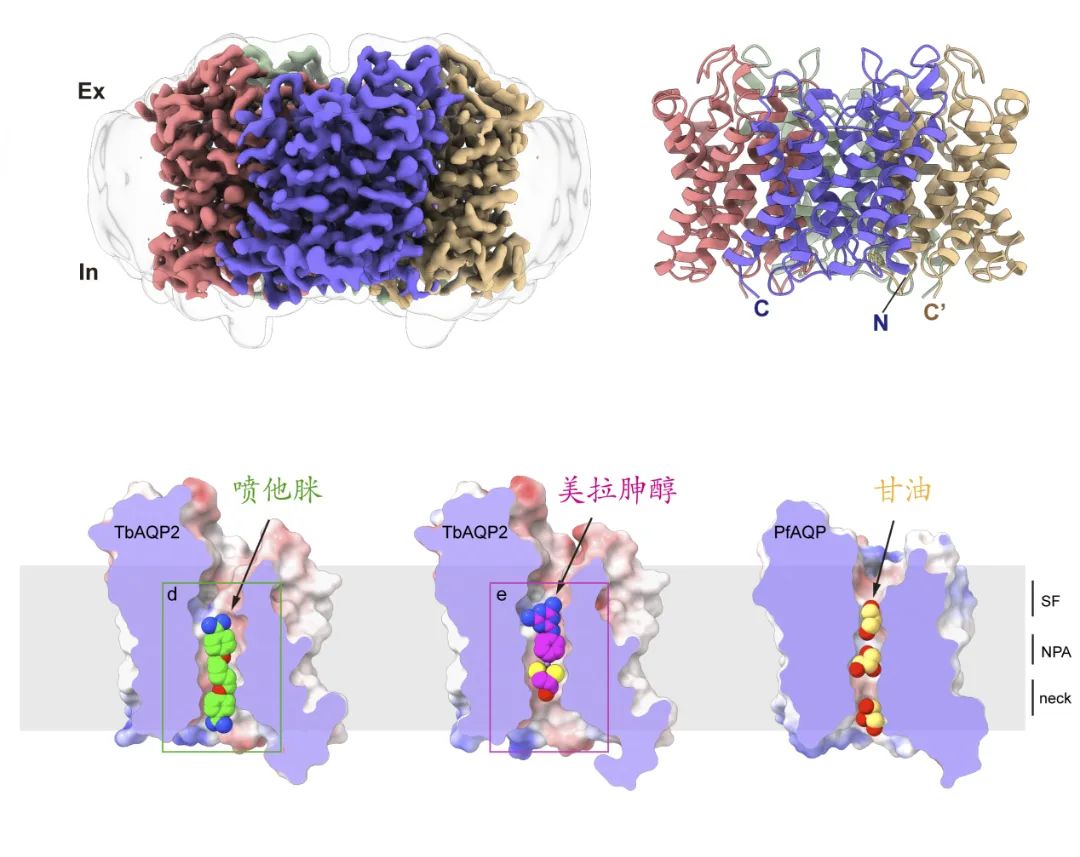
底物識(shí)別與轉(zhuǎn)運(yùn)的分子機(jī)制
閱讀原文
